Chap1. 서론
1-1 전지의 역사
전지(battery) : 전기화학반응을 이용하여 전극 물질의 화학에너지를 전기에너지로 직접 변환하는 시스템
1차전지(Primary battery) : 일정 수명기간 동안만 한 차례 사용이 가능
- 르클랑셰의 망간전지 → 산성 전해질을 수산화칼륨염(KOH)을 적용한 알칼리전지 → 리튬금속을 음극으로 적용한 3V급 리튬일차전지
2차전지(Secondary battery) : 재충전을 통해 장시간 반복 사용이 가능
- 플랑떼의 납축전지 → Ni/Cd 전지 → NiMH 전지 → 리튬이차전지
- 플랑떼의 납축전지 → Ni/Cd 전지 → NiMH 전지 → 리튬이차전지
1-2 전지기술의 혁명
- 리튬이온을 전극 및 전해질 내에서의 전하 전달체(charge carrier)로 사용하는 리튬 이차전지는 경량이면서도 3.7V 이상의 높은 평균 방전전압을 유지함으로써 현재 가장 높은 에너지 밀도를 나타냄
1-3 리튬이차전지 개요
이차전지 구조 : 양극과 음극이 충전과 방전을 반복적으로 수행할 수 있는 구조
전극 내에서는 이온의 삽입과 탈리가 용이하고 과정 중 전극의 구조가 용이
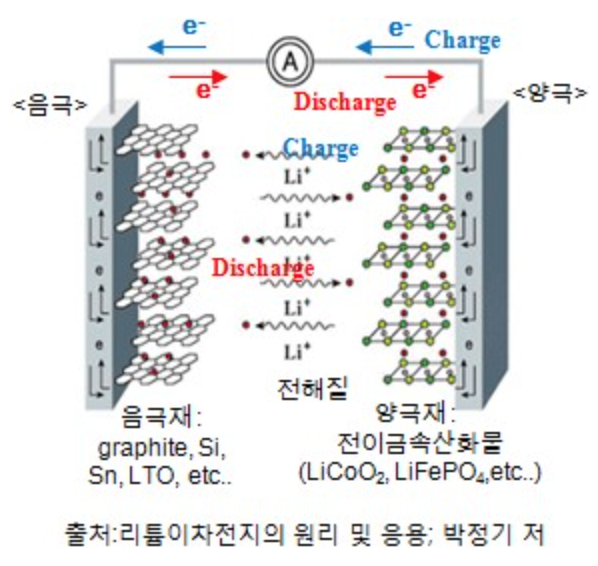
전지에서 전극 내로 삽입되는 이온은 집전체를 통해 전극으로 들어온 전자와 전하중성을 이루어 전극 내에 전기에너지를 저장하는 매개체가 된다. ⇒ 즉 전지의 전체 반응 속도에 크게 영향을 미치는 것은 전해질 및 전극 영역에서의 이온 이동속도 이다. 또한 저장가능한 전기 에너지의 양을 결정하는 것은 전하 중성을 위해 전극에 삽입된 이온의 양이다. → 전극의 소재와 이온의 종류가 실제 저장할 수 있는 전기에너지의 양 결정!
리튬 : 자연계 금속 중 가장 가볍고, 표준 환원전위가 가장 낮아 3V이상의 높은 기전력 & 중량 및 체적당 에너지 밀도가 높다.
- 작동 전압이 물분해 전압보다 높기 때문에 수용액 대신 유기용매를 전해질로 사용해야함
일반적으로 전이금속산화물(transition metal oxide)를 양극소재로, 탄소를 음극재로, 전해질로 액체전해질을 사용할 경우 리튬이온전지(LIB), 고분자전해질 사용시 리튬이온폴리머전지(LiPB)
원통형(cylindrical), 각형(prismatic), 코인형(coin), 파우치형(pouch) 존재

- (+): 리튬이 격자 구조의 일부분을 이루고 있다가 탈리 시에 이온의 형태로 빠져 나오기 때문에 구조적으로 안정한 전이금속계 산화물 소재 사용
- (-): 양극에서 빠져나온 리튬이온을 안정적으로 저장하고 큰 기전력을 제공하도록, 표준환원전위가 리튬과 크게 차이나지 않는 물질 사용
- 전해질: 작동 전압 범위 내에서 전기적 화학적 안정성을 유지하고 열 밀 화학적 안정성이 높은 리튬염과 유기용매 사용
- 분리막 : 고온에서 용융될 수 있는 고분자 또는 세라믹 물질을 사용
1-4 리튬이차전지의 미래
- 초소형 전지
- 플렉시블 전지
- 완전 고체형 리튬 이차전지
- 고분자형 전해질 or 무기계 또는 유.무기계 복합계 전해질의 개발