Chap3-1. 리튬 이차전지용 주요 소재 - 양극 활물질
3-1 양극 활물질
양극 활물질 개발 역사
intercalation : 활물질의 격자구조 변화없이 리튬 이온이 삽입/탈리 되는 현상
\(Li/CF_n\): 주기율표 상에서 가장 전기음성도가 큰 불소를 탄소 화합물의 층간에 intecalation
\(Li/MnO_2\): 기존의 1~1.5V에서 분해되는 수용액 대신에 유기 전해액을 사용하여 3V의 높은 작동전압을 갖게 됨
활물질에 따라 \( Li(CF)_n,\ Li/MnO_2,\ LiSO_2,\ LiSOCl_2 \) 등이 사용되며 이들 중 \(LiMnO_2\)가 가장 널리 사용되고 있다. \(LiSO_2, LiSOCl_2\)는 저온성능과 내구성이 뛰어나지만 인체에 유해한 물질을 사용하므로 특수 목적에만 사용된다.
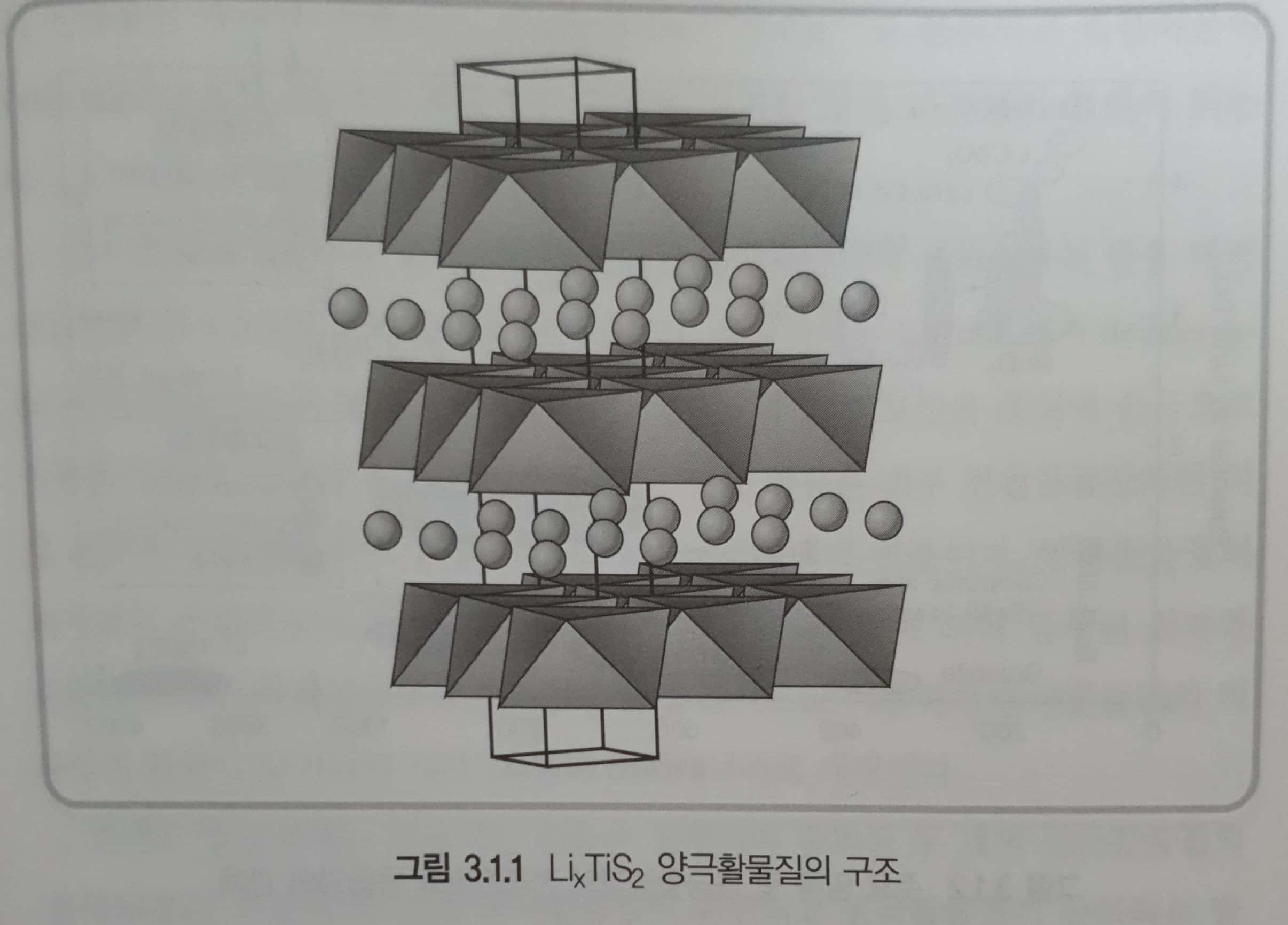
양극 측면에서는 높은 전기전도도를 갖는 층상물질에 전기화학적 반응성이 큰 물질을 intercalation하려는 다양한 연구가 시도되었다. 그 결과 \(TiS_2\)와 같은 calcogen화합물이 층간 intercalation 반응을 함이 확인되었고 리튬2차전지 상업화의 기초가 되었다.
\(TiS_2\)는 매우 가볍고 반금속성이므로 도전재를 첨가하지 않고 전극재료로 사용할 수 있고, 전지의 충방전 시 구조의 변화 없이 가역적으로 리튬의 intercalation-deintercalation이 가능하다. 하지만 합성이 어렵고 원료가 비싸 상용화 하지 못했다.
\(MoS_2\)를 기초로 한 LIB를 개발하였으나 리튬 음극의 수지상(dendrite) 성장으로 인한 내부 단락과 발화의 문제로 상용화에 실패했다.
전극 전위가 낮은 칼코겐족 화합물대신에 여러 산화물이 고려되었으나 상용화 되지 못하였으며, \(LiCoO_2\)를 양극으로, 탄소를 음극으로 사용하는 LIB가 상용화됨으로써 전극 활물질의 연구가 활발해졌다.
\(LiCoO_2\)의 경우 Li+가 탄소 내부로 intercalation되면서 \(Li_xC_6\) 화합물을 형성하기 떄문에 리튬금속을 음극으로 사용할 경우에 발생하는 리튬의 수지상 성장에 의한 내부단락 문제가 해결되었다. 또한 탄소의 환원전위가 금속 리튬보다 0.1~0.3V높지만, \(LiCoO_2\)의 전위가 상대적으로 훨씬 더 높으므로 탄소/\(LiCoC_2\)의 평균 전압은 3.7V가 된다. 리튬이온 확산계수는 비슷하나 전기전도도는 intercalation된 리튬의 양에 따라 반도체와 금속사이의 값을 가질 정도로 매우 우수하다.
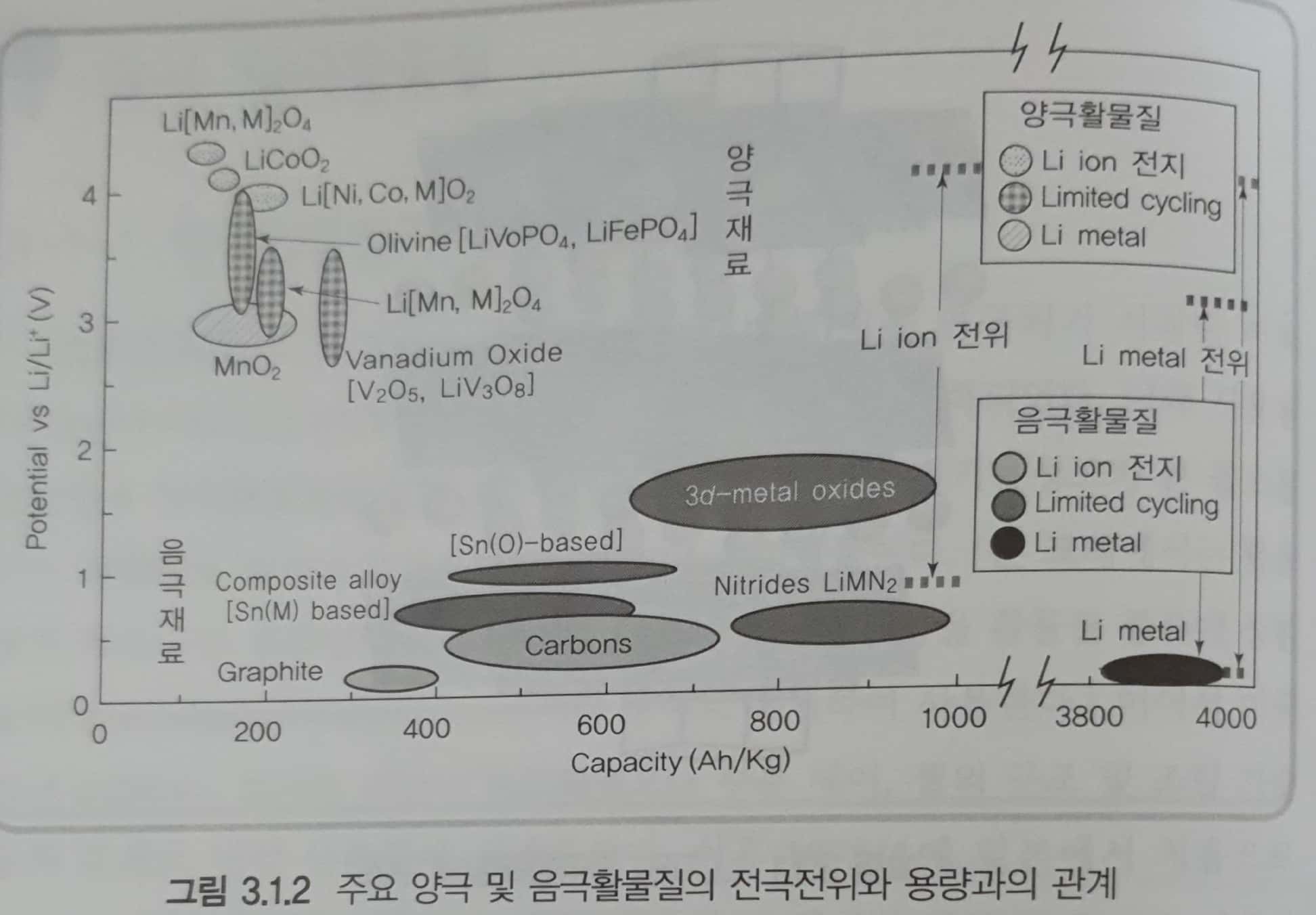
- 스피넬 \(LiMn_2O_4\)는 구조적으로 안정하며, \(LiNiO_2\)는 70% 이상의 이튬이 가역적으로 충,방전될 수 있어 고용량 재료로서 주목을 받았다. 하지만 스피넬 \(LiMn_2O_4\)는 용량이 작고 고온에서 망간이온 용출에 의해 성능이 저하되며, \(LiNiO_2\)는 전지 안정성 측면에서 문제가 있다.
- 따라서 장점을 혼합한 \(Li[Ni, Mn, Co]O_2\)가 각광을 받고 있다. 이외에도 철을 포함하는 \(LiFePO_4\)에 대한 연구도 활발하게 진행되고 있다.
양극활물질의 개요
A. 양극활물질의 산화, 환원반응
- \(LiCoO2\)의 경우 충전 과정에서는 Li+가 격자 밖으로 deintercalation되고, Co+3이 Co+4로 산화되면서 외부 도선으로 전자를 방출한다. 방전 과정에서는 외부 도선을 통해 전달받은 전자에 의해 \(Li{1-x}CoO2\)의 Co+4가 Co+3으로 환원되고 Li+이 intercalation된다. 따라서 자발적인 특성을 가지는 방전 과정에서 환원이 되는 \(Li{1-x}CoO_2\) 를 포함하는 것이 양극이 된다.

- 충전시에는 \(LiCoO_2\)에서 deintercalation된 Li+과 방출된 e가 각각 전해질과 외부 도선을 통하여 음극으로 이동하여 탄소 내애서 다시 결합하게 된다. 이들 반응은 외부 전원공급장치에 의해 공급된 전기에너지의 도움으로 일어나는 비자발적인 반응이다. 양극활물질의 산화반응에 의해 발생된 e와 Li+가 각각 외부회로와 전해질을 통해 음극으로 이동하며 음극활물질의 비자발적인 환원이 일어나게 되며 그 결과 화학 에너지로 저장 된다.

- 방전시에는 자발적인 반응이 진행되며 충전된 두개의 전극활물질의 전위차에 의해 양극활물질이 환원되고 음극 활물질이 산화된다. 방전시 음극활물질의 자발적인 산화로 인해 제공된 전자는 외부회로를 통해 이동하면서 기기를 작동시킨 후, 양극 활물질을 환원시킨다. 동시에 음극활물질에서 deintercalcation된 Li+은 전해질을 통해서 양극활물질 내로 intercalation된다.
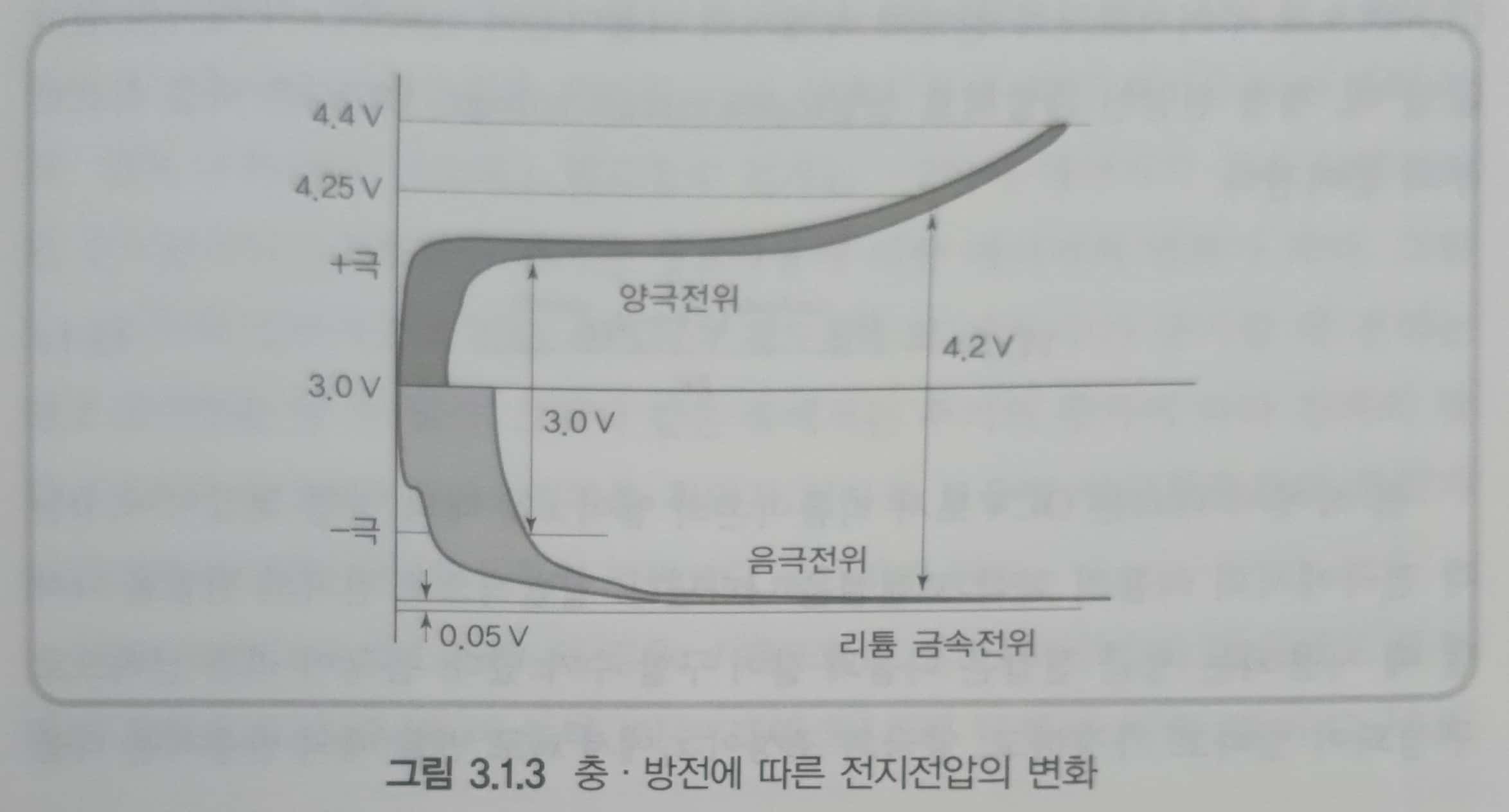
- 그림 3.1.3의 화살표로 나타낸 방전에 의해 양극활물질의 전위는 낮아지고, 음극활물질의 전위는 높아지므로 전지의 전위는 4.2V에서 3.0V로 감소하게 된다.
B. 방전 전위 곡선
- 전지의 전압은 충,방전 상태에 따라 변하기 때문에, 일반적으로 방전 구간 중간 지점의 전압을 공칭전압(nomial voltage)로 표시한다.
- 양극과 음극활물질의 결정 내부로 리튬이 intercalation/deintercalation되는 동안에 전자의 배치와 궤도함수(orbital)의 준위가 변하기 때문에 전지의 전위는 변한다. 실제 전위는 방전 과정에서 (+, -) 활물질의 각각 페르미 준위의 변화와 intercalation된 Li+ 사이의 상호작용에 의해 Armand식 (2.24)로 나타낼 수 있다.
- 방전 시 양극활물질은 환원되면서 기준전극(Li/Li+)과의 에너지 차이가 점점 감소하므로, 전지 전위는 점점 나아진다(그림 2.3.2). 이 기울기는 양극활물질 입자표면에서의 리튬이온 확산정도, 활물질의 상전이, 결정구조의 붕괴, 활물질을 이루는 전이금속 이온의 전해질로의 용출 의 영향을 받음.
- 동일한 율속에서도 충,방전 곡선은 양극활물질의 입자크기 및 입도분포, 온도, 양극활물질/도전재/바인더의 혼합조건, 전해질 특성, 분리막의 가공구조에 따라 달라질 수 있다.
- 전압을 음극과 양극에서의 리튬이온이 갖는 화학 포텐셜의 차이로 해석할 수 있다. 리튬이온의 화학 포텐셜 \(μ\)은 리튬이온의 함량에 대한 전극물질의 자유에너지의 부분 미분 값으로 정의된다. 리튬의 조성이 \(Li_xMX\)으로 주어지고, z가 전해액 속에서 Li+의 산화수, e가 전자의 전하값일 때, 개방회로 전압 OCV는
\[(3.1)\quad V(x)=-\frac{μ_{Li}^{cathode}(x)-μ_{Li}^{anode}}{ze} \]
- \(V(x)\)는 OCV로서 Li+의 양이 x일때 평형 전압이며, \(μ\)는 각 전극에서의 리튬 화학 포텐셜을 나타낸다.
- 음극이 리튬 금속이고 양극의 조성이 \(x_1 \rightarrow x_2\) 변할 떄 반응 식은 다음과 같다.ㄴ
\[(3.2)\quad Li_{x_1}MX(cathode)+(x_2-x_1)Li(anode)\rightarrow Li_{x_2}MX \]
- 위 반응의 자유에너지가 \( \triangle G \)라고 하면, 전지의 평균 전압은
\[ (3.3)\quad V=\frac{-\triangle G}{(x_2-x_1)ze} \]
- Li+의 화학 포텐셜에 미치는 여러 인자들은 방전 전압에 직접적인 영향을 미친다.
- Li+이 결정 격자 내에서 위치가 바뀔 때에 리튬의 화학 포텐셜이 변화되기 때문에 방전 전압을 변화시킨다. 즉 리튬이 활물질 결정 내에서 자리하는 위치에 따라 자리 에너지(site energy)도 변하게 된다. 이에 따라 \(Li_2Mn_2O_4/LiMn_2O_4\) 스피넬구조에서 다른 자리에 위치하고 있는 두 개의 Li+은 전위가 다르다. 또한 동일한 Co 이온이라도 층상형 \(LiCoO_2\)에서의 전위는 약 3.6~3.7V지만, 스피넬형 \(LiMnCoO_4\)에서는 약 4.5V의 높은 전위를 보인다.
- 결정 구조 내 Li+ 사이의 거리도 Li+의 화학포텐셜에 영향을 주어 방전전위를 변화시킨다. 예를 들어, 층상의 \(Li_2NiO_2\)와 Immm구조의 \(Li_2NiO_2\)에서 Li+ 사이 거리가 서로 달라서, Li+ 사이의 반발력이 다르게 작용하기 때문에 방전 전위가 서로 다르게 나타난다.

- 양극활물질의 산소의 p 궤도함수와 전이금속의 d 궤도 함수 전자들 간의 상호작용에 의한 전이금속 자체의 산화, 환원 전위이다. 산소의 p 궤도함수 전자는 -2이며 에너지가 거의 이렁하지만 전이금속의 d 궤도함수 전자는 상호작용에 의한 에너지 변화가 크다. 그림 3.1.4로부터 일반적으로 같은 주기의 d 궤도함수 전자 수가 증가할 때 전위는 점점 증가함을 알 수 있다. 그러나 같은 족에서는 주기의 증가에 따라 전자의 결합에너지가 감소하므로, 3d 전자를 최외각 전자로 보유한 양극활물질의 전위가 4d 전자를 보유가 양극활물질의 전위보다 높아지게 된다.
- 그러나 \(LiCoO_2\)와 \(LiNiO_2\)의 경우, d 궤도함수 전자는 Ni가 더 많음에도 불구하고, 전압은 \(LiCoO_2\)가 더 높다. 이는 \(Co^{3+}\)와 \(Ni^{3+}\)의 에너지준위가 부분적으로 역전되기 때문이다. 에너지가 높은 \(Ni^{3+}\)의 전자가 더 쉽게 방출되기 때문에 \(Ni^{3+}\)의 전지전위가 더 낮아진다.
- 유도 효과(inductive effect)에 의한 에너지 차이도 방전전위에 영향을 미친다. 이외에도 비평형 분극 현상도 전지의 전압에 큰 영향을 미친다. 특히 양극에서의 Li+나 전자의 이동에 대한 저항이 클 경우, 충방전시 전기화학적 평형상태에 도달하지 못하고 전압강하 현상이 발생하여 전지의 전압이 크게 감소한다.
C. 양극활물질의 요구특성
- 많은 양의 Li+이 intercalation-deintercalation되며, 충방전 과정의 에너지 효율을 높이기 위해서는 넓은 범위의 조성에서 가역적인 반응과 일정한 평탄 전위를 나타내야 한다.
- 단위 무게 또는 단위 부피당 고용량을 갖도록, 가볍고 구조가 치밀해야 하며, 고출력을 위해 전자전도도와 이온전도도가 높아야 한다.
- 사이클 효율이 높아야 한다. Li+의 순환과 관계없는 부반응이 일어나면 효율이 낮아진다.
- 결정구조의 비가역적 상전이는 전지의 수명을 단축시킨다. 또한 결정격자의 부피변화가 크면 활물질이 집전체로부터 탈착되어 용량이 감소한다.
- 전해질 등과 반응하지 않도록 화학적 또는 전기화학적으로 안정해야 하며 열적으로도 안정해야 한다.
- 입자가 구형이고 입도의 분포범위가 좁아야 한다. 이는 입자들 사이의 접촉효율과 함꼐 전기전도도를 향상시키고, 극판을 만들 때 집전체인 알루미늄 박막에 손상을 주지 않도록 하기 위함이다.
D. 주요 양극활물질
- 양극활물질 양이온 : 주로 3d 전이금속 ⇒ 4d, 5d에 비해 전극전위가 높고, 상대적으로 가볍고 크기가 작아 단위 무게 및 단위 부피당 용량에서 유리
- 음이온 : 반복된 산화,환원 반응에 따른 구조적인 안정성 측변에서 칼코겐족이 할로겐족보다 뛰어나며, 산소가 가장 효율적이다.
- 충,방전시 전이금속 산화물의 전하중성을 위해서는 양이온이 양극과 음극활물질로 intercalation/deintercalation 때나 전해질 내를 이동할 때 매우 쉽고 빠르게 이루어져야 한다. 양이온이 가역적으로 넓은 산화,환원 전위영역을 갖고 빠른 충방전을 하거나 전극활물질의 결정구조 변화를 최소화 하기 위해서는 크기가 작고 활물질과의 결합력이 약한 특성을 보이는 전하수가 낮은 양이온을 선택해야한다.
- 베릴륨 이온 \(Be^{2+}\)의 이온반경은 배위수가 6일때, 0.45A이므로 리튬이온의 0.76A보다 작지만, 전하수가 크기 때문에 산소화 결합력이 강하다. 따라서 결정구조 내에서 베릴륨 이온이 이동할 때 결정 내의 다른 양이온과 크게 반발하므로 이온의 이동 속도가 느리기 때문에 전극물질의 양이온으로 베릴륨은 적합하지 않다. 반면 리튬이온은 베릴륨 이온을 제외한 다른 후보 원자들보다 크기가 작고 낮은 전하수로 인해 양이온으로 적합하다.
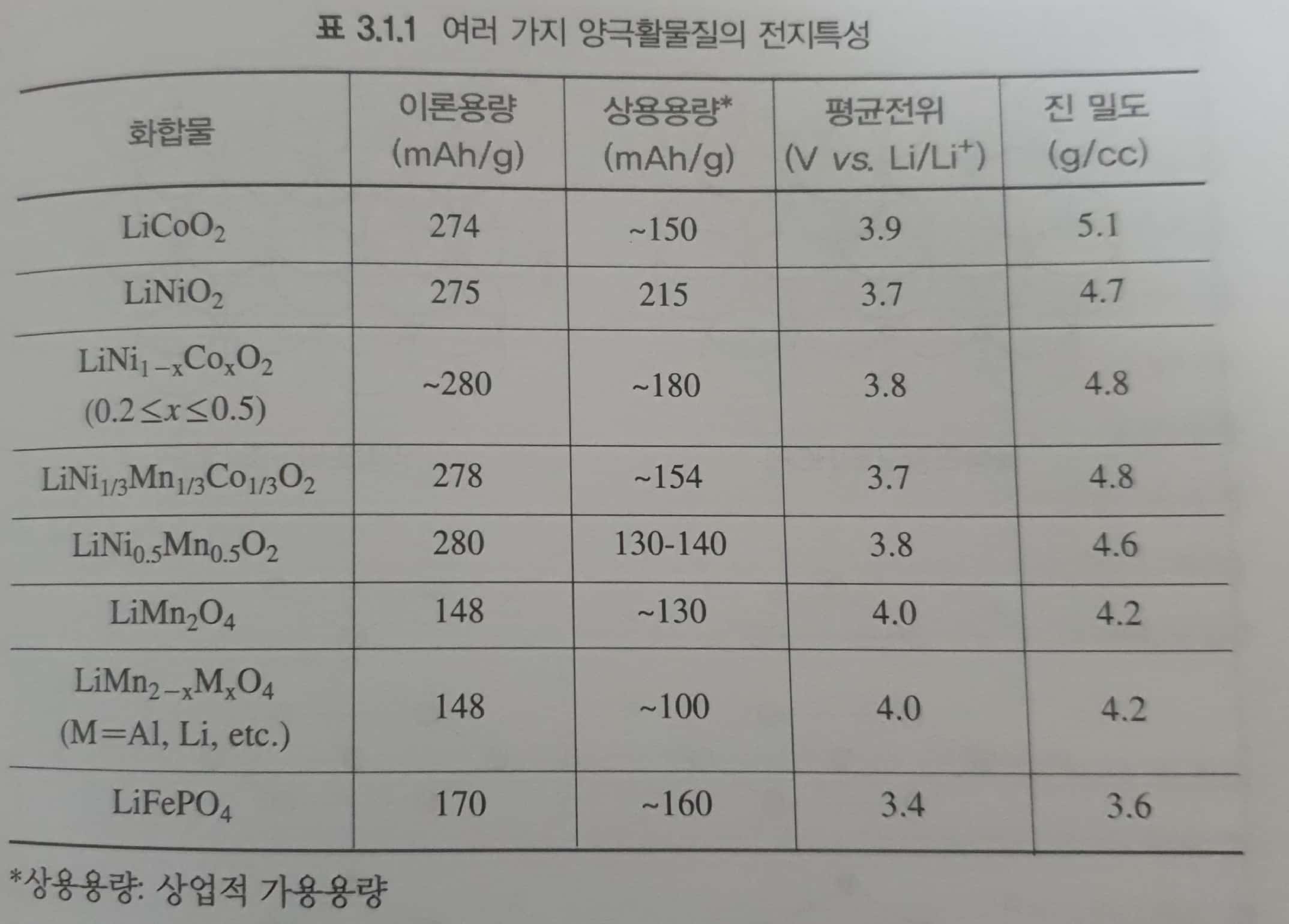
- 대표적인 양극활물질
- 리튬 전이금속 산화물인 층상구조의 \(LiMO_2\)
- 스피넬 구조의 \(LiMPO_4\)
- 리튬전이금속 다중산화합물인 올리빈 구조의 \(LiMPO_4\)
- 서로 다른 결정구조와 조성을 가진 양극활물질을 용도에 맞게 단순 혼합하거나, 표면도포, 복합체 형성 등의 방법을 통한 연구도 활발히 진행중
양극활물질의 구조 및 전기화학적 특성
층상구조 화합물
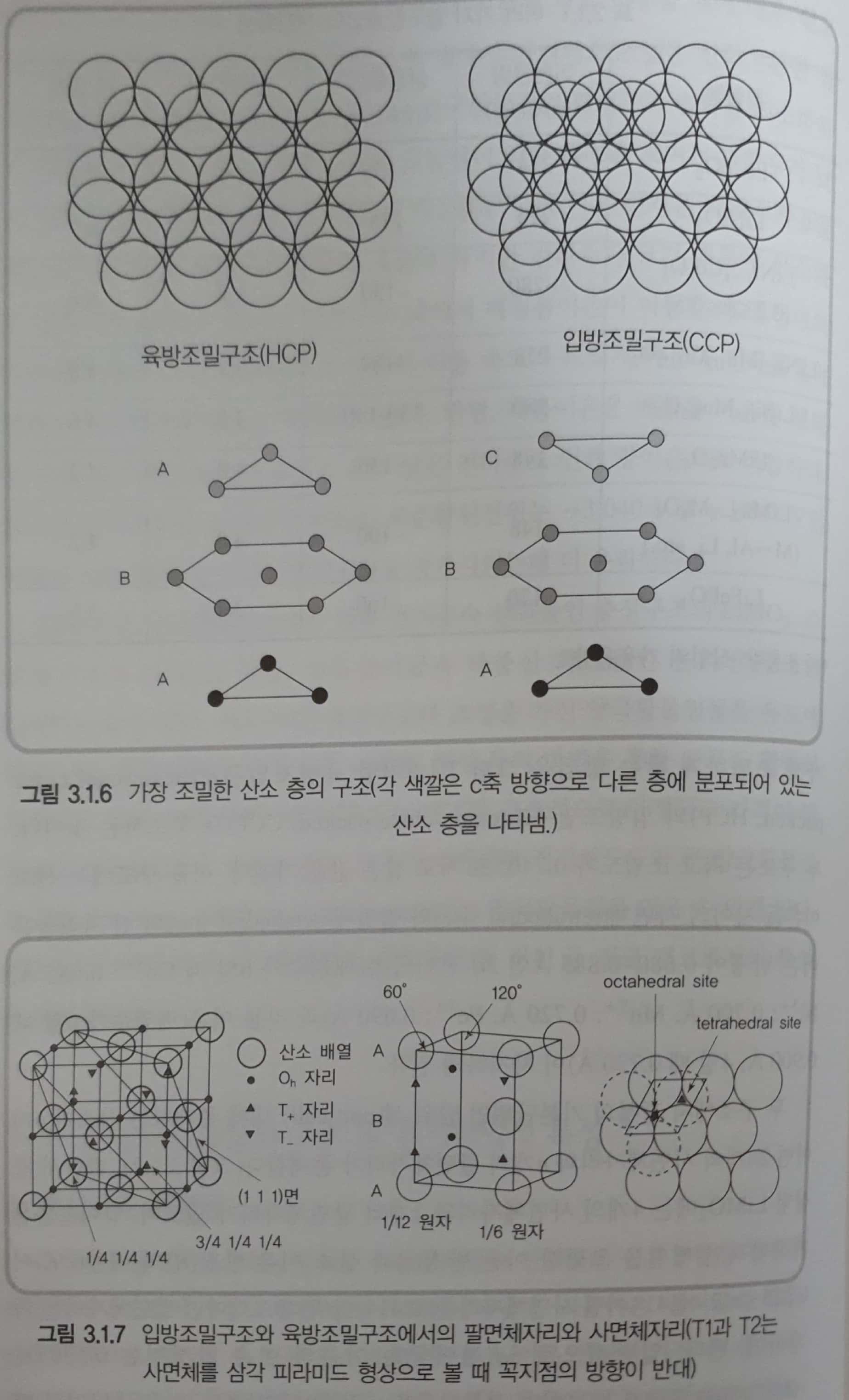
- 층상구조의 \(LiMO_2\)형태의 리튬전이금속 산화물은 이온결합성 결정구조를 형성함으로써 가장 조밀한 결정구조를 나타낸다. 리튬이온, 전이금속 이온, 산소 이온으로 형성될 수 있는 최조밀 결정구조는 이온 반경이 가장 큰 산소 이온으로 우선 조밀한 층을 쌓고 축조된 산소 이온들 사이의 빈 공간에 리튬이온과 전이금속 이온이 배열되어 충진 밀도를 최고로 높이는 구조이다.
- 산소 이온 층을 가장 조밀하게 쌓는 방법은 육방조밀구조(hexagonal close packed, HCP)와 입방조밀구조(Cubic close packed, CCP)이다. 두 구조는 최고 조밀도가 0.7405로 같은 값을 가지며, 이들 구조에서 사면체(tetrahedral site)와 팔면체(octahedral site)의 빈자리 들은 이온 반경이 0.680~0.885A인 3d 전이금속(배위수가 6일 때 \(Co^{3+}\):0.685A, \(Ni^{3+}\): 0.700A, \(Mn^{3+}\): 0.720A, \(Fe^{3+}\): 0.690A)과 리튬이온(배위수가 6일 때 0.900A, 4일때 0.730A)이 차지하게 된다.
- 두 구조에서 결정의 기본단위인 단위 셀(unit cell) 내에 존재하는 산소가 n개이면 2n개의 사면체 자리와 n개의 팔면체자리가 존재한다. 따라서 층상형 \(LiMO_2\)에서는 4개의 사면체 자리와 2개의 팔면체 자리가 있으며, 양이온들은 기하학적인 배열을 고려한 이온 반경(r)과 산소 이온 반경(R)의 비율(r/R)이 \(0.225\leq r/R < 0.414\)이면 사면체 자리를 \(0.414\leq r/R < 0.732\)이면 팔면체자리를 차지한다.
- \(LiMO_2\)에서 2개의 팔면체 자리들은 전이금속 이온과 리튬이온으로 채워진다. 이 경우 팔면체 자리와 사면체자리는 서로 가깝기 때문에 사면체자리에 추가로 Li+를 intercalation시키기는 어렵다.
- 2차원 모서리 공유는 층상 구조를 형성할 뿐만 아니라 직접적인 M-M 상호작용으로 전자전도도를 향상시키고 충,방전에 따른 부피변화를 감소시키는 효과도 있다. \(LiMO_2\)는 리튬, 전이금속, 산소가 규칙적인 O-Li-O-M-O-Li-O-M-O 배열의 층상구조를 형성한다. → ABCABC의 입방조밀구조의 팔면체 자리를 리튬이온과 전이금속이 50%씩 차지함
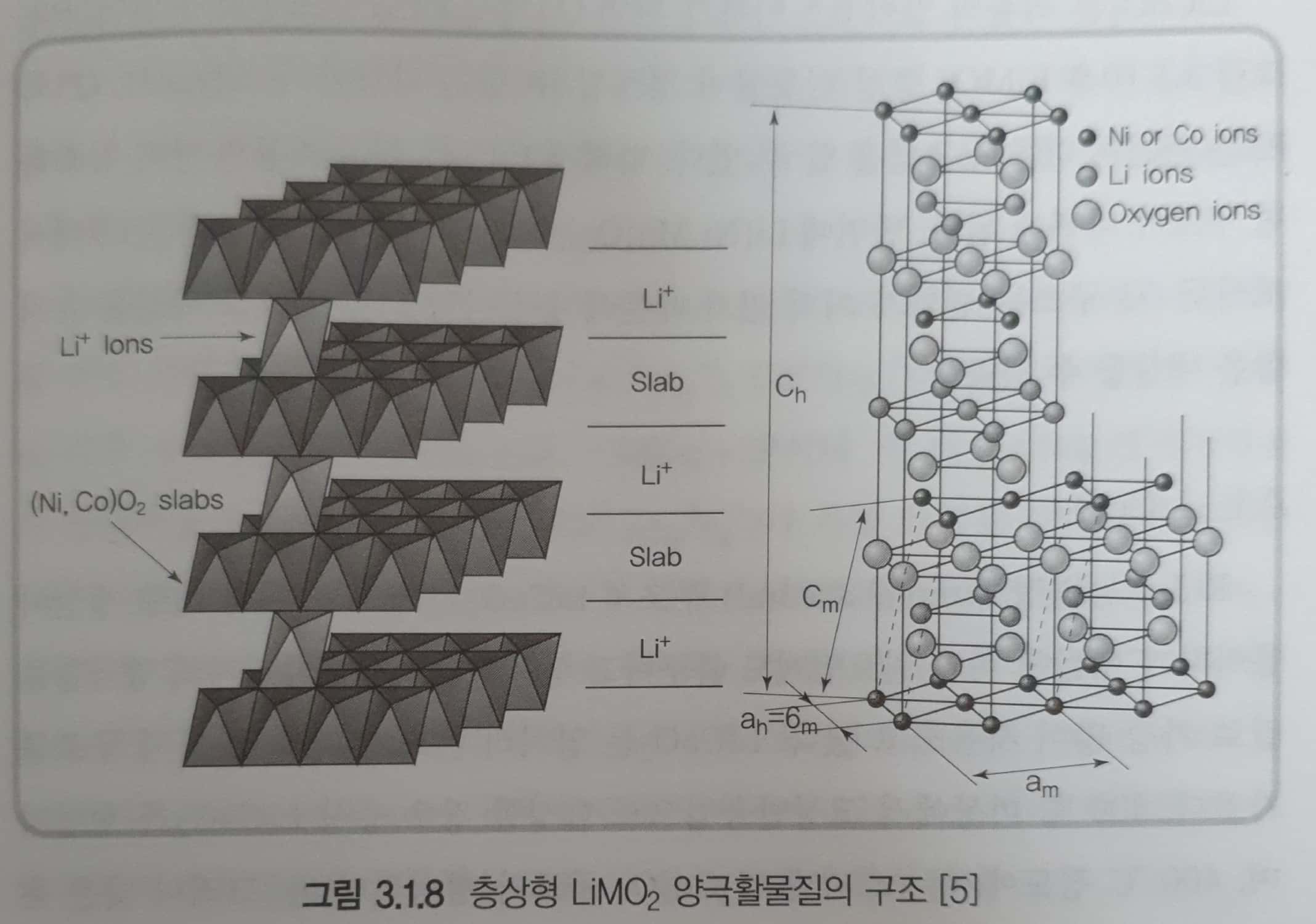
- 전이금속과 산소로 구성된 금속 산화물 층과 리튬을 둘러싸고 있는 산소 팔면체 층이 서로 교대로 배열하고 있다. \(MO_2\)층 내부는 강한이온결합을 형성하며 층 사이 쿨롱 반발력이 있으므로 리튬이온은 intercalation/deintercalation이 가능하며 2차원 평면을 따라 확산하므로 이온전도도가 높다.
- 충전 시 입자 표면의 리튬이온이 deintercalation 되면서 형성된 빈 팔면체자리로 인접한 Li+이 순차적으로 확산되면서 deintercalation됨
- 방전 시 반대로 입자 표면의 빈 팔면체 자리로 Li+이 intercalation 됨
- 방전 초기에는 이온전도도가 전자전도도보다 낮기 때문에 활물질 표면에 Li+이 쌓였다가 평형에 이를 때까지 순차적으로 확산된다. 따라서 충,방전 과정에서 열린 회로와 닫힌 회로 사이에 전위차가 발생하게 된다.
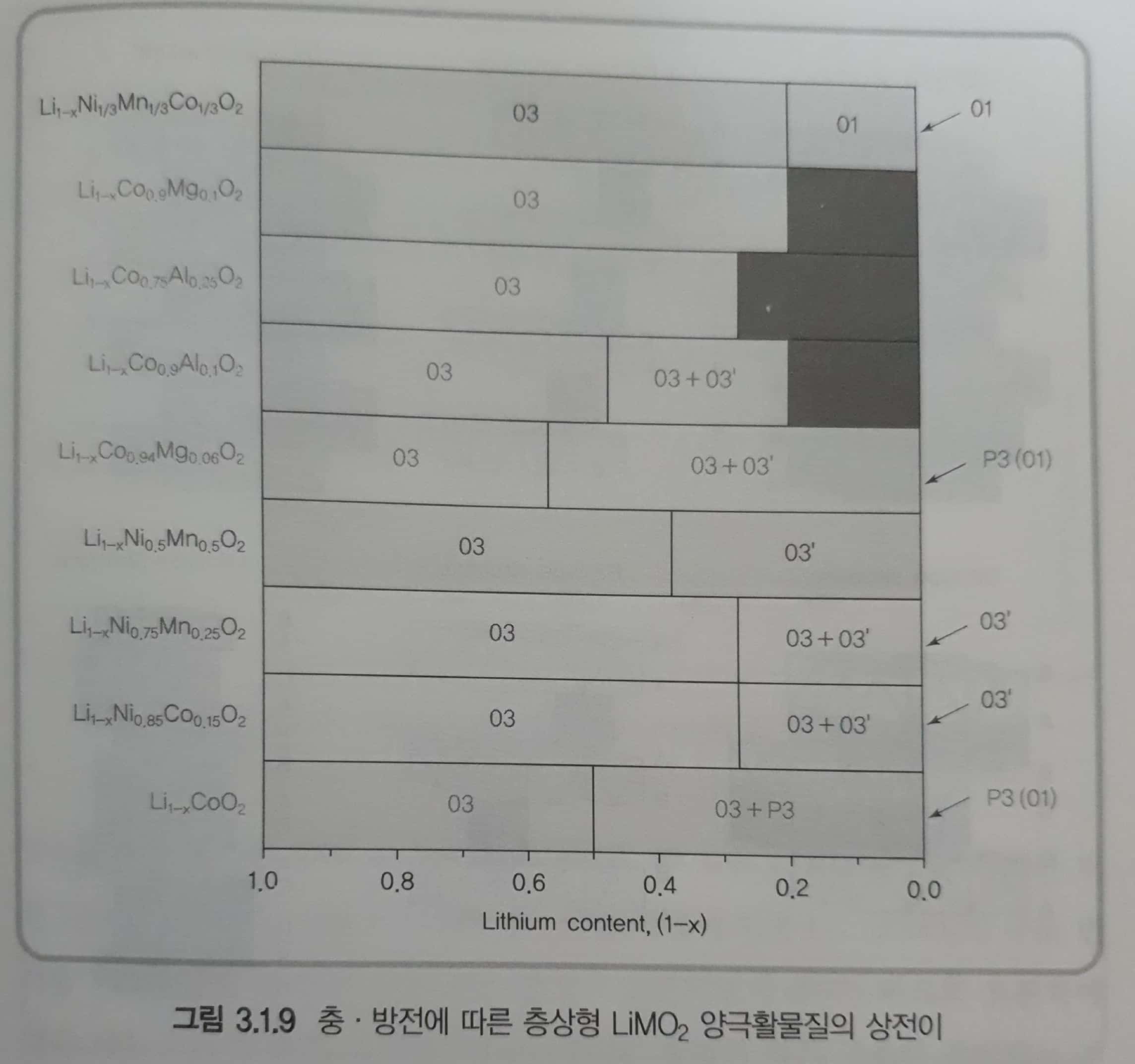
- 충전 과정에서 리튬이 빠져나가면 \(MO_2\)층의 산소원자들 간의 반발력에 의해 c축 방향으로 결정이 팽창하거나, 리튬이 완전히 빠져나가면 c축 방향으로 급격히 수축하는 층상형 \(LiMO_2\) 활물질은 다양한 상의 변화를 나타낸다. 즉 양극 활물질은 충전 과정에서 리튬 함량에 따라서 구조적으로 안정한 결정구조를 갖는 상으로 전이가 일어남. 이때 활물질로 사용할 수 있는 영역은 상전이가 없는 단일상 영역임.
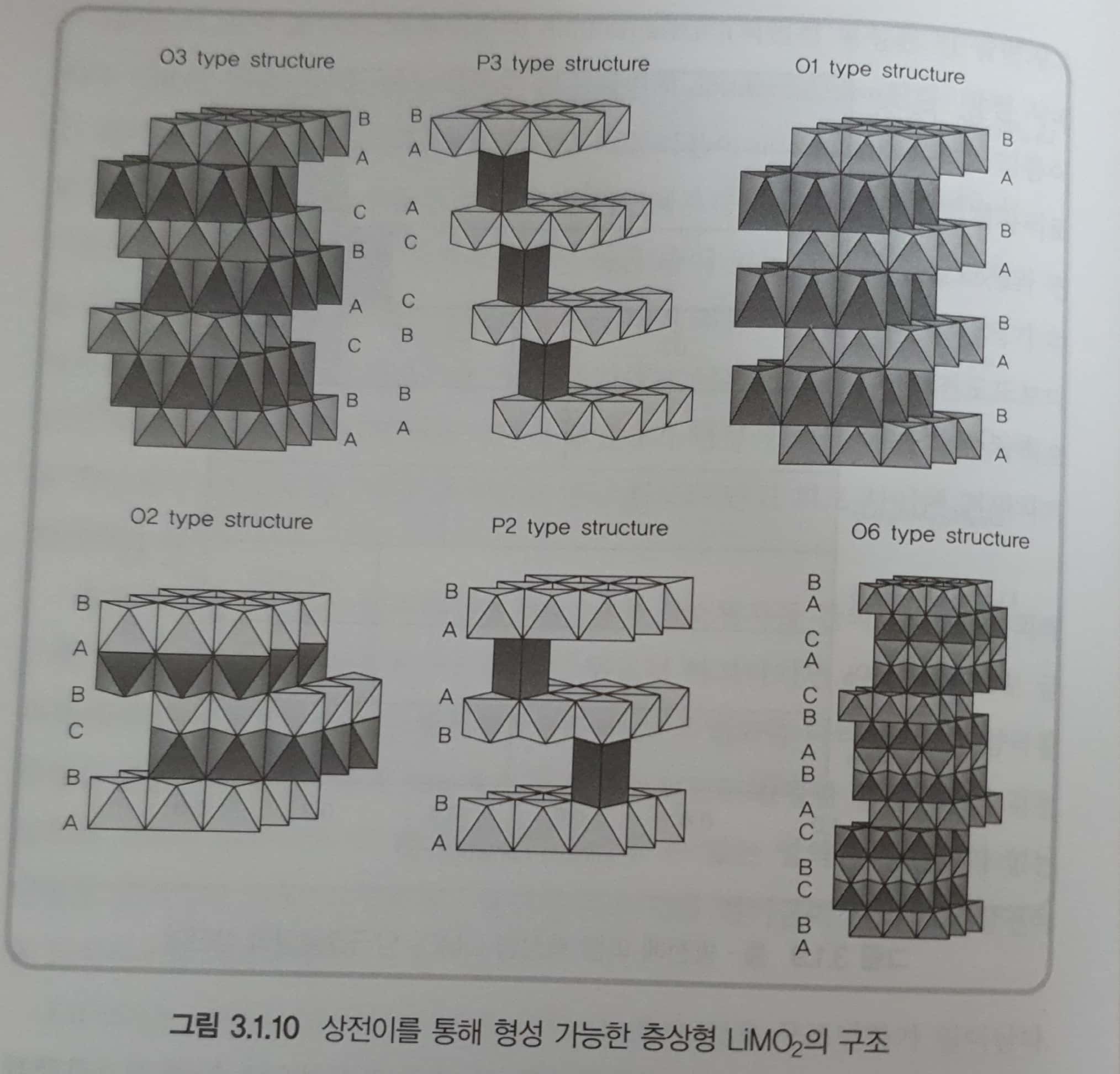
- \(LiCoO_2\)는 리튬의 양이 0.5이하가 되면 O3에서 P3로 구조변화가 일어난다. \(Li[Ni,Mn]O_2\)는 리튬의 양에따라 O3 구조는 변화가 없으므로 충전전압을 높여도 그 특성을 유지함을 예상할 수 있다.
A.1. \(LiCoO_2\)
- R-3m 능면정계(rhombohedral) 구조의 \(LiCoO_2\)는 제조가 쉬워 대량 생산이 용이하기 때문에 비싼 원료임에도 불구하고 가장 많이 사용됨